Considerazioni
La criptosporidiosi è senza dubbio una malattia molto grave e che non deve essere presa sotto gamba, ma troppo spesso fra gli appassionati di rettili viene citata a sproposito o additata come colpevole di condizioni al contrario reversibili.
Il primo passo è sempre comprare da allevatori affidabili e con cui sia possibile instaurare un dialogo anche dopo l’acquisto; importante cercare di evitare animali di cattura (WC) perchè proprio questi possono essere veicolo di numerose malattie o parassiti, fra cui anche Cryptosporidium.
Una buona quarantena rappresenta la base per evitare di introdurre nel proprio allevamento (o nella propria casa) la maggior parte delle malattie infettive e parassitarie, e nei rettili può avere una durata ben più lunga dei canonici 40 giorni a cui siamo abituati.
Avere un confronto con un veterinario esperto in rettili prima degli acquisti rappresenta un valido punta di partenza per evitare spiacevoli inconvenienti.
In caso di dubbi o sospetti è fondamentale FARE DIAGNOSI (e non basarsi sui soli sintomi) prima di prendere decisioni avventate.
Conosciamo il nemico
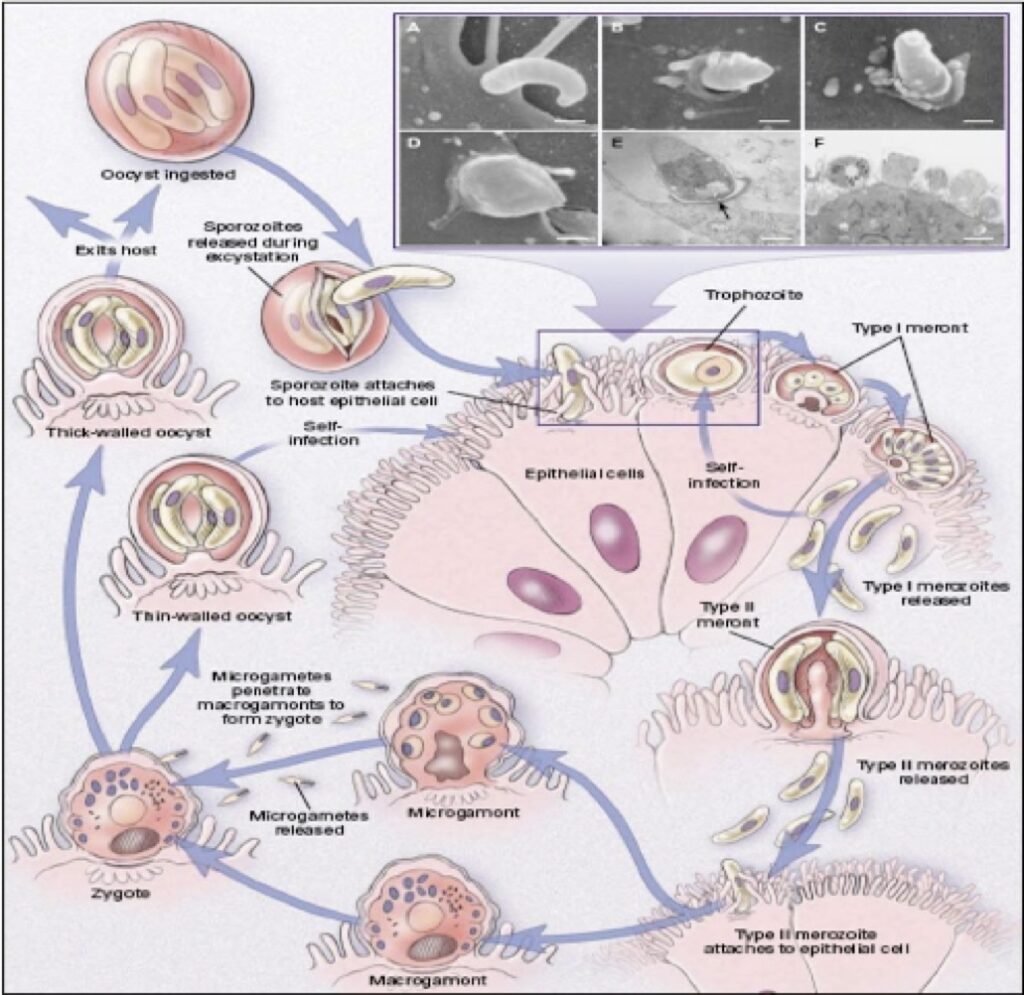
Le infezioni da Cryptosporidium, un protozoo appartenente al Phylum Apicomplexa, sono state riportate in almeno 57 specie diverse di rettili.
Purtroppo, a differenza di altri animali in cui le infezioni da Cryptosporidium sono autolimitanti nel tempo, nei rettili esitano spesso in patologie debilitanti, croniche e spesso letali.
Per questo motivo nell’ambito dell’allevamento amatoriale di rettili, Cryptosporidium è stato sempre visto come una “bestia nera” sulla quale occorre però fare un po’ di chiarezza.
Nei rettili “domestici” si riconosce l’implicazione di due specie in particolare:
- C. serpentis (colpisce soprattutto serpenti, ha oocisti più grandi e sede prevalentemente gastrica)
- C. varanii sin. C. saurophilum (colpisce sauri, ha oocisti più piccole e sede intestinale)
Altre specie sono state descritte, come C. muris, C. parvum, C. parvum genotipo ratto (sin. C. tyzzeri), ma queste oocisti potrebbero derivare dall’intestino delle prede ingerite.
Sintomatologia e trasmissione del parassita
I segni clinici variano a seconda dell’organo colpito, e la gravità dipende da vari fattori fra cui l’immunocompetenza dell’ospite.
Nel caso di infestazioni gastriche, il sintomo più comune è il vomito (o il rigurgito) causato dall’incapacità di digerire le prede, con conseguente perdita di peso progressiva.
Questa incapacità digestiva è data dall’inspessimento delle pliche gastriche e dalla riduzione della motilità, che causano spesso gonfiori palpabili nella regione gastrica dei serpenti infetti, e vomito o rigurgito 3-5 giorni dopo il pasto.
Nel caso di infestazioni intestinali, il sintomo più evidente è di solito la diarrea persistente, accompagnata da anoressia, perdita di peso e scadimento rapido delle condizioni corporee.
Nei gechi leopardini o nei fat tail si definisce “stick tail disease” perchè un tratto caratteristico è la coda (di solito riserva di grasso) ridotta a pelle e ossa.

La trasmissione del parassita è di solito oro-fecale, ed avviene attravarso le oocisti.
Le oocisti sono strutture molto resistenti, che possono resistere nell’ambiente (e anche a molti disinfettanti) per anni e che, una volta ingerite da un altro rettile, si schiudono dando origine all’infestazione.
Le cellule gastriche o enteriche colpite si gonfiano e perdono gradualmente la capacità di digerire il cibo, dando origine alla sintomatologia clinica.
Fattori predisponenti
Come si può intuire da quanto sopra, le probabilità di contrarre il parassita aumentano esponenzialmente in condizioni di allevamento non ottimali (scarse condizioni igieniche, sbalzi di temperatura, sovraffollamento o altre fonti di stress) e in caso di errori nella quarantena dei nuovi arrivi.
Diagnosi
La diagnosi rappresenta un nodo cruciale nell’identificazione del problema, essendo i segni clinici non patognomonici.
A seguito di una visita clinica e della raccolta dell’anamnesi, possono essere richiesti esami differenti a seconda della sintomatologia presentata dall’animale, che possono inclurere radiografie, esami del sangue, gastroscopia con eventuale prelievo bioptico, ed esami delle feci.
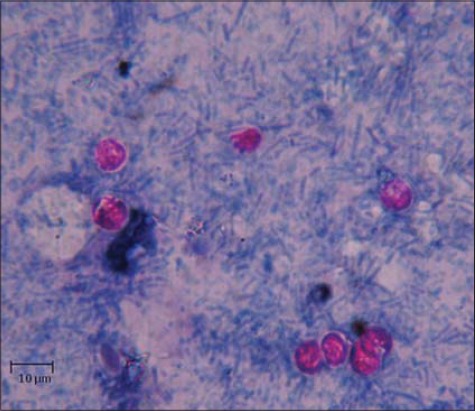
La diagnosi definitiva viene eseguita attraverso un esame delle feci con una colorazione particolare, o tramite ricerca del DNA del parassita mediante PCR.
Trattamento
Una volta eseguita la diagnosi di criptosporidiosi, si valutano le opzioni di trattamento.
Purtroppo ad oggi il Cryptosporidium è difficile da trattare e altamente infettivo per altri rettili, perciò le scelte sono sempre legate al numero di animali coinvolti ed alle loro condizioni corporee.
Sono disponibili terapie di supporto e terapie farmacologiche che possono rallentare la replicazione del parassita, ma ad oggi non si conosce una cura efficace che debelli il parassita.
BIBLIOGRAFIA
1)” Genetic diversity of Cryptosporidium spp. in Captive Reptiles“
Lihua Xiao, Una M. Ryan, Thaddeus K. Graczyk, Josef Limor, Lixia Li, Mark Kombert, Randy Junge, Irshad M. Sulaiman, Ling Zhou, Michael J. Arrowood, Břetislav Koudela, David Modrý, Altaf A. Lal Appl Environ Microbiol. 2004 Feb; 70(2): 891–899. doi:10.1128/AEM.70.2.891-899.2004
2) “Cryptosporidium varanii infection in leopard geckos (Eublepharis macularius) in Argentina”
A. Dellarupe, J.M. Unzaga, G. Moré, M. Kienast, A. Larsen, C. Stiebel, M. Rambeaud, M.C. Venturini Open Vet J. 2016; 6(2): 98–101. Published online 2016 Jun 28. doi: 10.4314/ovj.v6i2.5
3)”Prevalence of cryptosporidium infection and characteristics of oocyst shedding in a breeding colony of leopard geckos (Eublepharis macularius)” Deming C, Greiner E, Uhl E.W. J. Zoo Wildl. Med. 2008;39:600–607.